2025年1月,浙江大学医学院附属第二医院研究团队在《Stem Cell Research & Therapy》(IF: 7.3)上发表题为《Mesenchymal stem cells-derived exosomes attenuate mouse non-heart-beating liver transplantation through Mir-17-5p-regulated Kupffer cell pyroptosis》的研究文章。该研究聚焦于心脏死亡供体(DCD)肝移植中缺血再灌注损伤(IRI)的关键机制,首次揭示间充质干细胞外泌体(MSCs-Exo)通过miR-17-5p调控Kupffer细胞焦亡(pyroptosis),显著改善移植肝存活率与功能,为缓解全球供肝短缺提供了新策略。

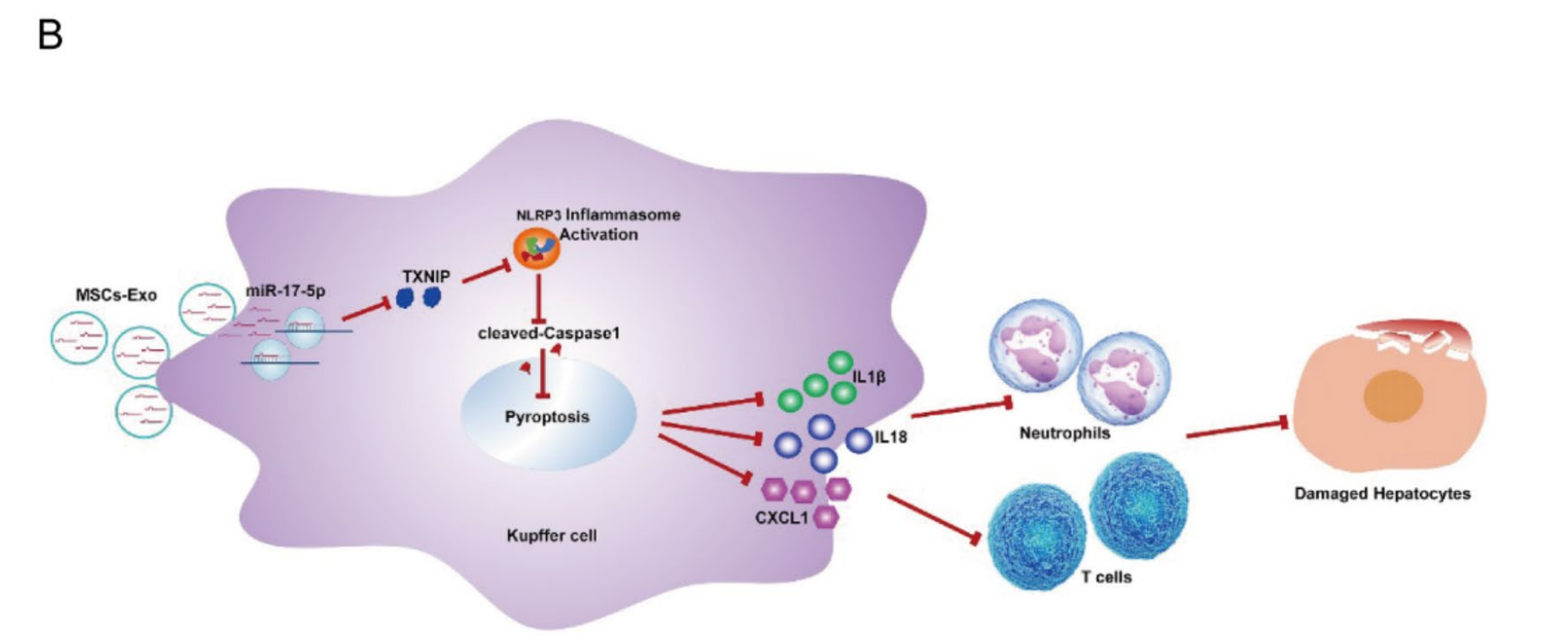
背景: 肝移植是终末期肝病最有效的治疗方法。然而,供体肝脏的短缺已成为肝移植推进的重大障碍。间充质干细胞来源的外泌体 (MSCs-Exo) 已在肝病中得到广泛研究。然而,它们如何保护心源性死亡 (DCD) 肝脏后器官捐献的潜在机制仍不清楚。
方法: 该研究采用动脉化小鼠非心跳(NHB)肝移植模型研究MSCs-Exo对NHB肝移植的影响。研究其生存率、组织学、促炎细胞因子和趋化因子表达及其机制。
结果: 输注MSCs-Exo减少了DCD肝移植物组织的损伤。体外和体内实验表明,MSCs-Exo可以抑制过氧化氢诱导的库普弗细胞焦亡。作者发现miR-17-5p在MSCs-Exo中显著丰度,靶向和调控TXNIP表达。该作用通过经典的Caspase1依赖性途径抑制NLRP3介导的Kupffer细胞焦亡,减轻DCD肝移植物损伤。
结论: 该研究阐明了 MSCs-Exo 在 NHB 肝移植模型中的保护作用。该机制为MSCs-Exo在临床应用中改善肝移植质量、缓解肝移植器官短缺问题提供了理论依据和新策略。
多因子检测技术助力肝移植研究:
研究中,团队采用LabEx多因子液相芯片平台(LX-MultiDTM-31),对移植后小鼠血清中31种炎症因子与趋化因子进行精准定量。结果显示,MSCs-Exo治疗组显著下调IL-1β、TNF-α、CXCL1等促炎因子,同时上调抗炎因子IL-10,证实其通过抑制Kupffer细胞焦亡-NLRP3炎症小体通路阻断级联炎症反应。LabEx平台的高灵敏度多靶点检测能力,为阐明外泌体免疫调控机制提供了关键数据支持。 总结与延伸:
研究首次将MSCs-Exo的miRNA cargo与移植肝免疫微环境重塑关联,为DCD供肝质量提升提供转化医学新思路。针对肝移植缺血再灌注损伤、慢性排斥反应及器官功能修复等研究方向,乐备实(LabEx)提供多重细胞因子/趋化因子检测全流程技术平台,加速肝脏疾病机制研究与治疗策略开发。“乐备实多重因子检测平台,正持续助力肝移植免疫调控与器官保护研究突破!”
参考文献:
Tian, Yang et al. “Mesenchymal stem cells-derived exosomes attenuate mouse non-heart-beating liver transplantation through Mir-17-5p-regulated Kupffer cell pyroptosis.” Stem cell research & therapy vol. 16,1 57. 7 Feb. 2025, doi:10.1186/s13287-025-04169-wIF: 7.3 Q1 原文点击:备加速:Luminex多重细胞因子检测平台助力肝移植缺血再灌注损伤机制研究