肿瘤浸润淋巴细胞(Tumor-infiltrating lymphocyte,TILs),是指从肿瘤组织内部或肿瘤微环境中浸润、迁移而来的一类免疫细胞,核心功能是识别并攻击肿瘤细胞,是机体对抗肿瘤的关键 “免疫防线” 之一[1]。然而,肿瘤细胞中的TIL亚群的细胞数量非常低,很容易在分离时丢失。因此,高效分离TIL 细胞及其亚群进行细胞研究和临床治疗非常重要。
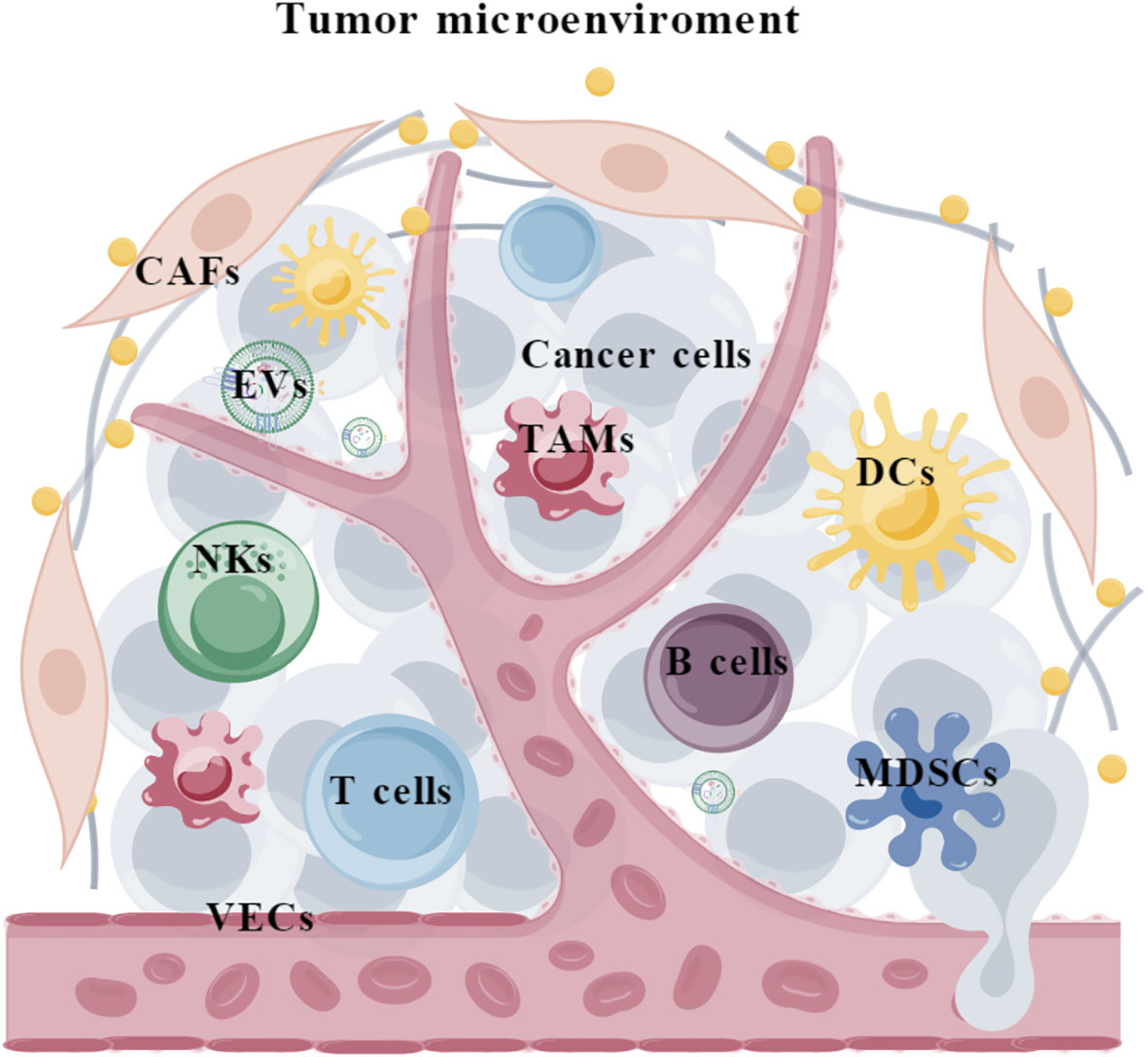
肿瘤微环境组成示意图[2]
美天旎针对肿瘤样本细胞异质性高、杂质干扰多、TIL 含量低且易损等痛点,专门研发 TIL分选磁珠。通过精准靶向 TIL 表面标志物及优化结合工艺,高效规避非特异性结合,提升分选回收率与纯度,为后续研究和免疫治疗提供高质量起始细胞。
美天旎TIL分选磁珠的优势:
● 靶向准纯度高:例如以 CD45 为特异性靶点,磁珠精准绑定 TIL,配合 MACS® 技术获 90%+ 纯度 CD45+ TIL,还可联用磁珠去红细胞,排除非免疫细胞
● 毒性低活性强:50nm 磁珠温和结合无损伤,分选无需离心避免应激,最大保留 TIL 杀瘤功能与扩增潜力,适配科研测序与临床回输
● 通量高效率优:单批处理达 1×10⁹细胞,超传统方法;流程标准化,配自动化设备提速,适配高通量科研与临床批量生产
本文将详细解析美天旎磁珠分选实验前后的关键注意事项,并深入解读三款热门TIL细胞磁珠分选实验流程(CD45、CD8),涉及阳性分选策略。助您一站式掌握肿瘤细胞磁珠分选核心技术!
关于磁珠分选实验,您务必要知道的关键点(耐心看完,后附分选实操案例)
分选前准备
❖ 确认磁珠:根据您的实验种属、样本来源、目的细胞marker选择适配的磁珠。
❖ 确认分选策略: 根据您实验的指标类型以及后续需求选择对应的分选策略。
阳性分选
目的细胞被磁性标记后,作为阳性标记组分直接分选出来。该方法常用于以下情况:
1. 分选表达单一表面标志物的细胞分选(如CD3+,CD4+,CD8+细胞)
2. 稀有细胞的分选 (如循环肿瘤细胞CTC、肿瘤浸润淋巴细胞TIL)
3. 表达较弱的表面标志物细胞分选(如CD133+细胞)
4. 去除特定细胞群分选(如TCRαβ+T去除、CD45RA+细胞去除)
阴性分选/去除分选
非目的细胞磁性标记后从细胞混合物中去除,即未磁性标记的细胞为目的细胞。该方法常用于以下情况:
1. 去除特定非目的细胞群
2. 缺乏目的细胞特异性表面标志物的分选(如某些肿瘤细胞、神经元)
3. 磁珠分选后需进一步通过阳性选择分选细胞亚群(CD4+CD25+Treg)
4. 分选后的细胞表面不可带有任何磁珠标记
顺序分选
联合使用两种分选策略,例如先阴选后阳选,或先使用可剪切的REAlease磁珠后进行阳性分选。该方法常用于以下情况:
1. 同步分离两种特定细胞亚群:首先通过阴性分选去除共同杂质细胞,随后利用阳性分选将剩余的目标细胞亚群分开
2. 目标抗原在非目的细胞上存在交叉表达,导致直接阳性分选纯度不足
3. 要分选极稀有的细胞,通过预富集步骤提高目的细胞的纯度和得率
全血分选
从血液样本中直接分选目的细胞,无需裂解红细胞,无需密度梯度离心。该方法常用于以下情况:
1. 简化实验流程,省去离心等操作步骤,短时间内获得高回收率,高活性的目的细胞
2. 针对血样样本量较少,可最大程度上节省样本的损失
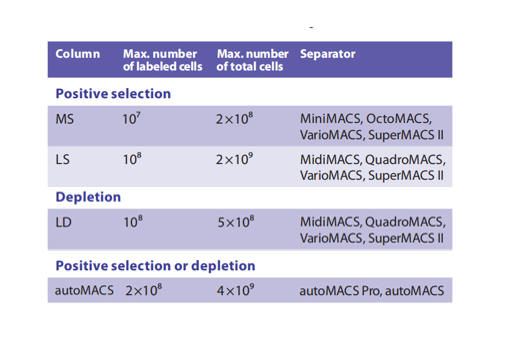
❖ 确认分选柱:对于不同类型的分选柱选择,关键是不要超过推荐的细胞量,否则会使柱子过载,导致分选效果不佳。可根据您的细胞总数和目标细胞数、分选策略选择对应的分选柱,可参考下图。对于具体使用的磁珠,参考每个磁珠说明书附的数据表,进行分选柱的选择。
注:全血分选磁珠需搭配全血分选柱套装(# 130-093-545),其中包含全血分选柱和全血分选缓冲液。
相关产品货号:
相关产品货号:
❖ 确认分选平台:根据您的分选柱,选择适配的分选平台。

相关产品货号:
注:全血分选柱可搭配Midi MACS分选器(#130-042-302)或 QuadroMACS Separator分选器 (# 130-090-976)
❖ 准备分选缓冲液:
方案1:将MACS BSA Stock Solution(#130-091-376)和autoMACS Rinsing Solution(#130-091-222)按照1:20配置,作为分选buffer;分选缓冲液需放置4°预冷。
方案2:如您的细胞对于叠氮化钠成分不敏感,可直接选择autoMACS Running Buffer(#130-091-221)进行分选。该buffer内含有少量的叠氮化钠,对某些敏感细胞,例如神经细胞造成影响。
方案3:含0.5%BSA(abs9156-50g)、2mM EDTA(abs9133)的PBS(abs962),配置后调整PH至7.2,需去除气泡,气泡可能导致分选柱堵塞。配好的buffer可先静置,也可使用真空抽滤、超声消除气泡。
❖ 细胞计数和活性检测:
分选前需要检测单细胞样本的细胞量及细胞活率,通过细胞量计算您的磁珠添加量;建议起始单细胞活率达到85%以上再进行磁珠分选,会得到较为理想的实验结果。
您可以选择对应产品提升样本的初始活性:
细胞筛网:利用细胞筛网将粗提的单细胞悬液过筛,过滤组织团块,可根据您的细胞大小选择合适孔径的筛网(MACS® SmartStrainers70μm#130-098-462或70um细胞筛网#abs7232)
碎片去除试剂:利用密度梯度离心的原理去除碎片(Debris Removal Solution#130-109-398或细胞分离液#abs9102)、
死细胞去除磁珠:磁珠标记死细胞表面的磷脂酰丝氨酸,通过高强度磁场,将死细胞去除( Dead Cell Removal Kit #130-090-101)、
裂红试剂:利用细胞内外存在盐离子浓度差而导致细胞膜胀破的原理来裂解无核红细胞。(Red Blood Cell Lysis Solution (10×)#130-094-183或红细胞裂解液(1×)#abs9101)
分选过程中:
一、磁珠篇:
❖ 美天旎磁珠为胶体溶液,不会沉淀,实验前不用摇晃即可直接使用。
❖ 磁珠说明书中推荐的磁珠标记的体积适用于1×107的细胞。当您的总细胞量少于107细胞,需按照说明使用相同的体积。当超过107细胞数,将所有试剂体积和总体积按照相应比例增加。
❖ 磁珠孵育温度根据说明书通常为2-8℃,建议在冰箱中避光孵育,直接放置于冰上会使磁珠结合效率变差。提高温度或延长孵育时间均可能导致非特异性磁性标记。如磁珠说明书中推荐孵育时间为(+19-25℃),则磁珠应在室温条件下避光孵育。
二、分选篇:
❖ 分选柱在加样前需使用缓冲液润洗,润洗分选柱的缓冲液请事先回温至操作环境温度,防止预冷的缓冲液润洗室温分选柱,导致分选柱中形成小气泡,使分选效果不佳。
❖ 整个分选过程要尽量快速操作,保持细胞处于低温,分选过程中使用的分选缓冲液需预冷,可防止抗体包裹在细胞表面以及非特异性的磁性标记。
❖ 每一次向分选柱中加液均需等到分选柱中的液体流空,最后一滴在分选柱中不滴出时,再进行下一步加液。
❖ 收集分选柱中磁珠标记的细胞液,需要将分选柱从磁场中拿下,放至收集管上,向分选柱加入缓冲液后立即进行栓塞按压;分选柱栓塞只能按压一次,请勿反复操作。
❖ 分选柱为一次性耗材,请勿重复使用。
分选结束后:
❖ 利用流式检测目的细胞占比及分选后细胞活性,计算出分选纯度和分选得率,您可参考以下公式进行计算:
· 分选纯度=分选后目的细胞总数量/分选后所得所有细胞总数量
· 分选得率=分选后目的细胞总数量/分选前目的细胞总数量
注意:分选前目的细胞总数量=标记后未上柱子前的细胞悬液*目的细胞占比
为您详细解读3款热门细胞分选实例,干货来袭,照搬流程直接做实验!
阳性分选:
CD45 (TIL) MicroBeads, mouse(#130-110-618)
CD45 (TIL) MicroBeads, human(#130-118-780)
CD8 (TIL) MicroBeads, mouse(# 130-116-478)
阳性分选:CD45 (TIL) MicroBeads, mouse(#130-110-618)
磁性分选耗材
❖ MS分选柱(#130-042-201)或LS分选柱(#130-042-401)
❖ MS分选柱对应的Mini MACS分选器(#130-042-102)或OctoMACS分选器(#130-042-109);
❖ LS分选柱对应的Midi MACS分选器(#130-042-302)或QuadroMACS分选器(#130-090-976);
❖ MACS MultiStand(#130-042-303)
❖ MACS BSA Stock Solution(#130-091-376)和autoMACS Rinsing Solution(#130-091-222)1:20配置
❖ Pre-Separation Filters 30μm预分离滤器(#130-041-407)(可选,磁珠标记前去除细胞团,防止堵塞分选柱)
实验步骤
一、磁珠标记CD45细胞
1.细胞计数;
2.细胞悬液300×g离心10分钟,弃上清;
3.细胞重悬,每1×107细胞添加80μL分选缓冲液;
4.每1×107细胞添加20 μLCD56 MicroBeads磁珠;
5.混匀,于2-8℃孵育15min;
6.(可选)添加荧光染色抗体
7.添加分选缓冲液,调整溶液体积至500 μL(注:500 μL体积最大重悬至5×107细胞,对于对于更多的细胞数量,需要相应提高缓冲液体积)
二、磁珠分选CD45细胞
1. 将分选柱放入对应的MACS分选器的磁场中,如需详细分选柱信息请查看MACS分选柱载量数据表;
2. 用适量缓冲液润洗分选柱,等到分选柱中液体排空后,再进行下一步骤(MS分选柱使用500 μL分选缓冲液润洗;LS分选柱使用3 mL分选缓冲液润洗);
3. 将制备好的细胞悬液加入分选柱中,收集的流穿细胞液为未被标记的细胞;
4. 分别用分选缓冲液清洗柱子三次(MS分选柱使用500 μL分选缓冲液清洗3次;LS分选柱使用1 mL分选缓冲液清洗2次),收集未被标记的非CD45细胞;
5. 从分选器中取出分选柱,将其放到合适的收集管上;
6. 吸取适量的缓冲液(MS:1 mL;LS:3 mL),加到分选柱中,立即将栓塞推入分选柱中,冲洗出磁珠标记的细胞,即为CD45细胞;
7. (可选)若需提高 CD45⁺细胞纯度,可将洗脱组分用新的 MS 或 LS 柱子重复步骤 1-6 再次分选。
阳性分选: CD45 (TIL) MicroBeads, human(#130-118-780)
磁性分选耗材
❖ MS分选柱(#130-042-201)或LS分选柱(#130-042-401)
❖ MS分选柱对应的Mini MACS分选器(#130-042-102)或OctoMACS分选器(#130-042-109);
❖ LS分选柱对应的Midi MACS分选器(#130-042-302)或QuadroMACS分选器(#130-090-976);
❖ MACS MultiStand(#130-042-303)
❖ MACS BSA Stock Solution(#130-091-376)和autoMACS Rinsing Solution(#130-091-222)1:20配置
❖ Pre-Separation Filters 30μm预分离滤器(#130-041-407)(可选,磁珠标记前去除细胞团,防止堵塞分选柱)
实验步骤
一、磁珠标记CD45细胞
1. 细胞计数;
2. 细胞悬液300×g离心5分钟,弃上清;
3. 细胞重悬,每1×107细胞添加80μL分选缓冲液;
4. 每1×107细胞添加20 μL CD45 (TIL) MicroBead磁珠;
5. 混匀,于2-8℃孵育15min;
6. (可选)添加荧光染色抗体
7.添加分选缓冲液,调整溶液体积至500 μL(注:500 μL体积最大重悬至5×107细胞,对于更多的细胞数量,需要相应提高缓冲液体积)
二、磁珠分选CD45细胞
1. 将分选柱放入对应的MACS分选器的磁场中,需详细分选柱信息请查看MACS分选柱载量数据表;
2. 用适量缓冲液润洗分选柱,等到分选柱中液体排空后,再进行下一步骤(MS分选柱使用500 μL分选缓冲液润洗;LS分选柱使用3 mL分选缓冲液润洗);
3. 将制备好的细胞悬液加入分选柱中,收集的流穿细胞液为未被标记的细胞;
4. 分别用分选缓冲液清洗柱子(MS分选柱使用500 μL分选缓冲液清洗3次;LS分选柱使用1 mL分选缓冲液清洗2次),收集未被标记的非CD45细胞;
5. 从分选器中取出分选柱,将其放到合适的收集管上;
6. 吸取适量的缓冲液(MS:1 mL;LS:3 mL),加到分选柱中,立即将栓塞推入分选柱中,冲洗出磁珠标记的细胞,即为CD45细胞;
7. (可选)若需提高 CD45⁺细胞纯度,可将洗脱组分用新的 MS 或 LS 柱子重复步骤 1-6 再次分选。
阳性分选:CD8 (TIL) MicroBeads, mouse(#130-116-478)
磁性分选耗材
❖ MS分选柱(#130-042-201)或LS分选柱(#130-042-401)
❖ MS分选柱对应的Mini MACS分选器(#130-042-102)或OctoMACS分选器(#130-042-109);
❖ LS分选柱对应的Midi MACS分选器(#130-042-302)或QuadroMACS分选器(#130-090-976);
❖ MACS MultiStand(#130-042-303)
❖ MACS BSA Stock Solution(#130-091-376)和autoMACS Rinsing Solution(#130-091-222)1:20配置
❖ Pre-Separation Filters 30μm预分离滤器(#130-041-407)(可选,磁珠标记前去除细胞团,防止堵塞分选柱)
实验步骤
一、磁珠标记CD8细胞
1. 细胞计数;
2. 细胞悬液300×g离心10分钟,弃上清;
3. 细胞重悬,每1×107细胞添加90μL分选缓冲液;
4. 每1×107细胞添加10 μL CD8 (TIL) MicroBead磁珠;
5. 混匀,于2-8℃孵育15min;
6. (可选)添加荧光染色抗体
7.添加分选缓冲液,调整溶液体积至500 μL(注:500 μL体积最大重悬至5×107细胞,对于更多的细胞数量,需要相应提高缓冲液体积,并且磁性分选时需将样本分至多个柱子中进行操作)
二、磁珠分选CD8细胞
1. 将分选柱放入对应的MACS分选器的磁场中,如需详细分选柱信息请查看MACS分选柱载量数据表;
2. 用适量缓冲液润洗分选柱,等到分选柱中液体排空后,再进行下一步骤(MS分选柱使用500 μL分选缓冲液润洗;LS分选柱使用3 mL分选缓冲液润洗);
3. 将制备好的细胞悬液加入分选柱中,收集的流穿细胞液为未被标记的细胞;
4. 分别用分选缓冲液清洗柱子两次(MS分选柱使用500 μL分选缓冲液清洗2次;LS分选柱使用1 mL分选缓冲液清洗2次),收集未被标记的非CD8细胞;
5. 从分选器中取出分选柱,将其放到合适的收集管上;
6. 吸取适量的缓冲液(MS:1 mL;LS:3 mL),加到分选柱中,立即将栓塞推入分选柱中,冲洗出磁珠标记的细胞,即为CD8细胞;
7. (可选)若需提高 CD8⁺细胞纯度,可将洗脱下来的细胞组分用新的 MS 或 LS 柱子重复步骤 1-6 再次分选。
以上就是三款热门TIL细胞磁珠分选的实验流程!想了解更多TIL细胞磁珠产品,小优为您总结了TIL细胞分选磁珠产品合集:
Human TIL细胞分选:
货号130-118-780 CD45 (TIL) MicroBeads
货号130-121-562 REAlease CD3 (TlL) MicroBead Kit, human
货号130-121-563 REAlease® CD45 (TIL) MicroBead Kit, human
货号130-121-559 REAlease CD4 (TlL) MicroBead Kit, human
货号130-121-560 REAlease CD8 (TlL) MicroBead Kit, human
货号130-121-561 REAlease CD4/CD8(TIL) MicroBead Kit, human
Mouse TIL细胞分选:
货号 130-110-618 CD45 (TIL) MicroBeads, mousa
货号 130-116-475 CD4(TIL)MicroBeads, mouse
货号 130-116-478 CD8 (TIL) MicroBeads, mouse
货号 130-116-480 CD4/CD8(1lL)MicroBeads, mouse
参考文献:
[1] Kumar A, Watkins R, Vilgelm AE. Cell Therapy With TILs: Training and Taming T Cells to Fight Cancer. Front Immunol. 2021;12:690499. doi: 10.3389/fimmu.2021.690499
[2] Su W, Che L, Liao W, et al. The RNA m6A writer METTL3 in tumor microenvironment: emerging roles and therapeutic implications. Front Immunol. 2024;15:1335774. doi:10.3389/fimmu.2024.1335774