一. 细胞起源与来源
MT-4细胞系源自人急性T淋巴细胞白血病(T-ALL),属于T细胞系来源的淋巴母细胞白血病模型。其免疫表型符合T-ALL特征:CD3阳性(胞质或膜表达),TdT阳性,而CD34和HLA-DR阴性。与其他T-ALL亚型不同,早期T前体淋巴母细胞白血病(ETP-ALL)具有独特的免疫表型积分系统(如CD5、CD8等表达异常),但MT-4不属于此亚型[1]。
二. 生物学特性
1. 形态与生长方式:
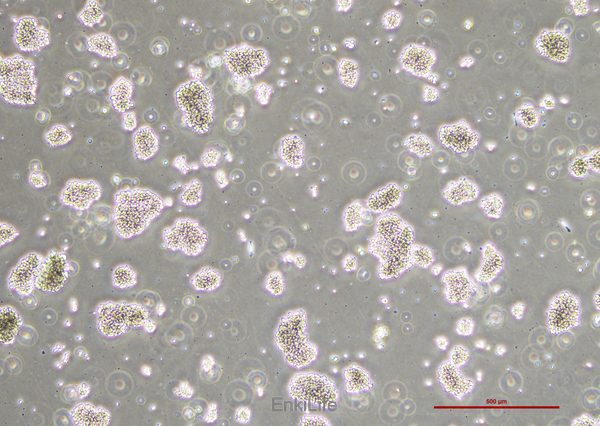
l 形态:MT-4细胞呈淋巴母细胞样,圆形。
l 生长方式:通常以悬浮方式生长。部分证据提到其可能存在"悬浮或贴壁"的混合特性,但多数明确为悬浮细胞,实际操作中需离心收集细胞,不可直接倒掉培养液[9]。
2. 遗传变异与信号通路
l NOTCH1突变:>50%的T-ALL存在NOTCH1基因激活突变(异二聚化域或PEST域),导致异常信号传导,促进细胞增殖和存活[2][7]。
l 癌基因协作:SCL和LMO1协同抑制胸腺细胞分化,并与pre-TCR信号共同促使NOTCH1突变累积,形成白血病起始细胞[5]。
l 代谢重编程:依赖氧化磷酸化过度激活,与骨髓微环境互动(如分泌CCL3、TGF-β1)重塑基质细胞,支持白血病进展[10][15]。
3. 表观调控与细胞周期
l SIRT1通路:通过去乙酰化CDK2促进p27泛素化降解,加速细胞周期进程[11]。
l 迁移与耐药:ABL1与Cofilin1相互作用增强细胞迁移;Rack1过表达通过PKCα活化导致化疗耐药[12][13]。
4. 免疫微环境互动
脐带血来源的Helios+ Treg细胞通过CCL22和VEGFA/VEGFR2通路促进血管生成及白血病细胞骨髓浸润[6]。
三. 培养与储存
l 标准培养条件:RPMI-1640+10% FBS+1% P/S+0.05mM β巯基乙醇。
l 推荐传代比例:3×10^5-5×10^5cells/mL。
l 推荐换液频率:2-3 次/周。
l 储存条件:30% 基础培养基+60%FBS+10%DMSO,液氮保存[9]。
四. 研究应用领域
1. 机制研究:NOTCH信号、代谢重编程、耐药机制的核心模型[5][7][15]。
2. 药物筛选:如白藜芦醇诱导S期阻滞和凋亡[8];γ-分泌酶抑制剂阻断NOTCH通路[7];CD47激动肽PKHB1诱导免疫原性死亡[16]。
3. 动物模型构建:转基因过表达(如Ttg-1、IL-7Rα)模拟白血病发生[14][17]。
五. 近几年研究进展(2020–2024)
1. 靶向代谢疗法:抑制线粒体复合物I可逆转NOTCH1驱动的代谢重编程,与化疗协同增效[15]。
2. 免疫微环境靶点:靶向Treg细胞(如抗Helios+)或VEGFR2通路抑制血管生成[6]。
3. 诊断标准更新:2024年中国指南明确ETP-ALL的免疫表型积分系统及分子预后分组[1]。
六. 局限性与克服方法
1. 局限性:
l 细胞系长期传代可能导致遗传漂变[18]。
l 微环境互作在体外难以完全模拟[10]。
3. 克服方法:
l 联合类器官共培养或小鼠PDX模型[10][17]。
l 开发双靶点抑制剂(如NOTCH1+代谢通路)[15]。
七. 总结与展望
MT-4细胞系是研究T-ALL分子机制的核心工具,尤其在NOTCH信号、代谢重编程和微环境互动领域。未来需进一步探索:
1. 精准分型:整合单细胞测序解析异质性[1][3]。
2. 临床转化:推进代谢抑制剂(如复合物I阻断剂)及免疫联合疗法[6][15]。
3. 模型优化:利用CRISPR构建基因编辑模型模拟患者特异性突变[5][17]。

参考文献
1. 王建祥, 等. 中国成人急性淋巴细胞白血病诊断与治疗指南(2024). 中华血液学杂志. 20210. DOI: 10.3760/cma.j.cn121090-20240410-00201
2. Activating Mutations of NOTCH1 in Human T Cell Acute Lymphoblastic Leukemia. Weng AP, et al. Science. 2004;306(5694):269-271. [PMID: 15472075]
3. The genetic basis of early T-cell precursor acute lymphoblastic leukaemia. Zhang J, et al. Nature. 2012;481(7380):157-164. PMID: [22237106]
4. Gene expression signatures define novel oncogenic pathways in T cell acute lymphoblastic leukemia. Ferrando AA, et al. Cancer Cell. 2002;1(1):75-85. [PMID: 12086892]
5. Modeling T-cell acute lymphoblastic leukemia induced by the SCL and LMO1 oncogenes. Tremblay M, et al. Genes Dev. 2010;24(11):1093-1106. [PMID: 20516194]
6. Umbilical cord blood-derived Helios-positive regulatory T cells promote angiogenesis in acute lymphoblastic leukemia in mice via CCL22 and the VEGFA-VEGFR2 pathway. Li X, et al. J Immunol Res. 2019;2019:1-17. [PMID: 30897865]
7. Downregulation of Notch signaling by γ-secretase inhibition can abrogate chemotherapy-induced apoptosis in T-ALL cell lines. Liu S, et al. Ann Hematol. 2009;88(7):677-688. [PMID: 19107443]
8. 劳凤学, 等. 白藜芦醇诱导急性T淋巴母细胞白血病Jurkat细胞凋亡. 中国药理学通报. 2006;22(3):342-349.
9. 人急性淋巴母细胞白血病细胞MT-4 说明书。武汉恩玑生命科技有限公司。
10. Metabolic crosstalk between stromal and malignant cells in the bone marrow niche. Tirado HA, et al. Leukemia. 2023;37(3):535-548. [PMID: 36717601]
11. SIRT1 regulates the phosphorylation and degradation of P27 by deacetylating CDK2 to promote T-cell acute lymphoblastic leukemia progression. Wang F, et al. Oncogene. 2021;40(17):3110-3122. [PMID: 33820982]
12. ABL1 and Cofilin1 promote T-cell acute lymphoblastic leukemia cell migration. Luo J, et al. Biochem Biophys Res Commun. 2021;570:55-61. [PMID: 34171574]
13. Increased PKCα activity by Rack1 overexpression is responsible for chemotherapy resistance in T-cell acute lymphoblastic leukemia-derived cell line. Lei J, et al. Cancer Chemother Pharmacol. 2016;78(5):1035-1044. [PMID: 27679487]
14. Thymic overexpression of Ttg-1 in transgenic mice results in T-cell acute lymphoblastic leukemia/lymphoma. McGuire EA, et al. Mol Cell Biol. 1992;12(9):4186-4195. [PMID: 1383689]
15. Inhibition of mitochondrial complex I reverses NOTCH1-driven metabolic reprogramming in T-cell acute lymphoblastic leukemia. Baran N, et al. Cancer Discov. 2022;12(6):1468-1486. [PMID: 35320340]
16. CD47 agonist peptide PKHB1 induces immunogenic cell death in T‐cell acute lymphoblastic leukemia cells. Uscanga-Palomeque AC, et al. Cancer Immunol Immunother. 2019;68(8):1215-1231. [PMID: 31214713]
17. Overexpression of wild-type IL-7Rα promotes T-cell acute lymphoblastic leukemia/lymphoma. Silva A, et al. Blood. 2021;138(19):1872-1888. [PMID: 33974034]
18. Automated synthesis of prexasertib and derivatives enabled by continuous-flow solid-phase synthesis. Liu C, et al. Nat Commun. 2021;12(1):2269. [PMID: 33875649]